
扫码关注

扫码入群
2019年初,美国FDA发出一封警告信,其原因是该药企违反了《药品供应链安全法》(DSCSA)中的验证要求和疑似装运违禁产品等规定。据该药企回复FDA的内容显示:该药企并不认为涉及被盗或转移控制物质的事件在公司内部应该视为DSCSA验证事件,且对非法产品的定义以及对贸易伙伴通知其非法产品的事件是该公司对自身责任缺乏了解。
收到警告信企业对美国FDA《药品供应链安全法案(DSCSA)》其核心内容的理解缺失,警告信回复更可能会面临挑战,从生产端到零售端的、全覆盖的处方药追踪追溯体系的建立需要一个过程,你了解、认识的追溯体系是什么样的。(11月天津)药品追溯系统最新法规解读、建设实施和计算化系统验证实践研修班,且看如何建立一个电子化的可供不同系统和组织相互沟通合作的药品供应链新体系。
事件背景
2013年美国国会为防范药品供应链风险,授权FDA颁布了《药品供应链安全法案(DSCSA)》,其核心内容是在2023年之前建立起从生产端到零售端的、全覆盖的处方药追踪追溯体系。在美国分配的处方药需要在整条供应链具备全面追溯能力,所有在美国销售药品、或为美国公司代工的中国制药企业也要遵守该法案。该法案已经于2018年11月27日正式生效,并要求药品供应链上的企业(包括药品生产企业、批发企业、零售终端等)对药品进行序列号管理、记录交易历史,对可疑药品进行身份核实,在2018-2023年间逐步建立一个电子化的可供不同系统和组织相互沟通合作的药品供应链新体系。
DSCSA法规规定:供应链的各方,必须在第二个工作日内响应FDA、联邦或当地政府发出的序列号验证要求。针对此次验证事件该药企并未了解企业责任,如若不纠正这些违法行为该事件可能会引发法律诉讼。
事件方案
美国药品序列化是响应触发式监管的实施方案,但必须要求从生产端到零售端的供应链参与者(分销商、药店、医院、批发商等)全部参与覆盖追踪追溯体系才能实现控制药品供应链风险的目标!
关于响应触发式监管,DSCSA法规中明确指出:供应链各方,一旦发现可疑药品,必须抽检该批药品,并与其他正常药品进行物理隔离,且及时通知上下游交易各方及FDA。
美国药品序列化产线建设
企业与美国监管机构对接系统如下:
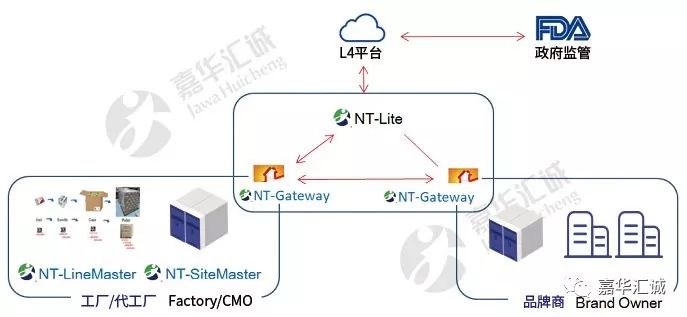
早在2015年,嘉华已成功助力全国某前十药企成功实施了中国第一条符合FDA序列化要求的项目产线,拉开了中国药品出口药序列化的序幕。
在美国,FDA会提供指导但不参与组建任何平台,因此并没有任何官方追溯平台。美国市场上有3个主要的商业追溯平台(也被称为L4平台),即:TraceLink、Rfxcel、SAP ATTP。
典型L4商业追溯平台的功能
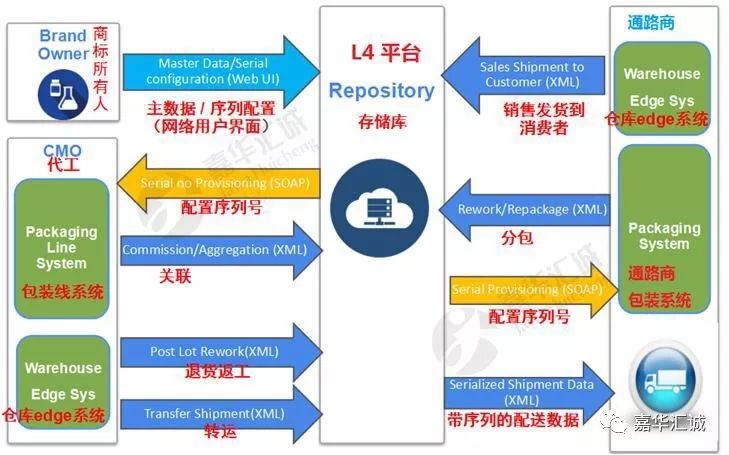
在美国药品序列化方面,大多数药企不能完全掌握序列化的细节、要求和时间节点,其中对标签、接口、及供应商皆有相关法规要求。国内企业不仅要在符合国内追溯要求的基础上考虑现有产线升级改造、出口美国合规,更要考虑未来产线拓展的可能性;以及企业现在及未来出口多国的可能性。
对接L4平台的简要步骤
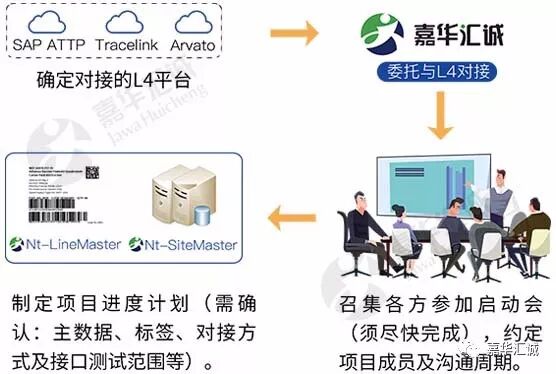
嘉华作为全球领先、专业、合规的序列化系统建设供应商,作为与美国三大L4平台多次合作经验的服务商,作为EMVO认可的19家OBP CP(接入服务商)之一,助力国内多家药企成功将药品出口欧美;同时提供专业的咨询服务,助力药企深入理解欧美出口药序列化法规;帮助药企解决序列化项目实施中出现的问题,轻松完成出口药序列化一站式服务。
本文部分内容/翻译整理自FDA官网
出口药序列化及欧美法规问题,请关注嘉华法规专家答疑系列。
【答疑系列一】欧盟及美国药品追溯法规相关问题
【答疑系列二】药品出口业务流程相关问题
【答疑系列三】药品序列化欧美平台对接相关问题
1
近期培训汇总
第二届全球视野下的实验室前沿技术与合规化管理峰会
(大会由2天全面升级为3天,六 大主题专场深耕细作,三天会议只收取880元,前100名报名参会,可享受680元的优惠价格 2019/11.27-29)
(11月天津)药品追溯系统最新法规解读、建设实施和计算化系统验证实践
(上海市食品药品安全研究会会长 唐老师 制药行业药品追溯与序列化主题专家 王雪晶 国际追溯序列化法规专家 霍然 资深计算机化系统验证、管理及DI合规性咨询专家 郭明刚 2019/11/08-09 天津)
(11月苏州) 基于GAMP5的计算机化系统生命周期合规管理实施研修班
(GAMP前编委Anwarul Haque 验证与风险管理专家马义岭教授 资深计算机化系统验证、管理及DI合规性咨询专家郭明刚 2019/11/15-16 苏州)
(11月珠海)多产品共线交叉污染的防控及清洁验证的实施
(资深专家,新版GMP指南编写人员丁老师 验证与风险管理专家马义岭教授 2019/11/21-22 珠海)
(11月武汉)OOS /OOT调查及实验数据完整性管理风险系统解决方案
(GAMP前编委Anwarul Haque 国内航母企业首席质量专家 安老师 2019/11.22-23)
(12月北京) 基于GAMP5的计算机化系统生命周期合规管理实施研修班
(GAMP前编委Anwarul Haque 资深计算机化系统验证、管理及DI合规性咨询专家郭明刚 2019/12/06-07 北京)
(12月杭州)基于FDA 工艺验证指南&PDA TR60的全生命周期工艺验证
( 验证与风险管理专家马义岭教授 资深GMP咨询顾问 李基 2019/12/17-18 杭州)
(12月长春)多产品共线交叉污染的防控及清洁验证的实施
(资深专家,新版GMP指南编写人员丁老师 验证与风险管理专家马义岭教授 2019/12/13-14 长春)