
点击下方蓝色字体可见培训内容!!
11月15日北京-2019质量QA岗位技能提升与完善专题培训
11月17日南京-新法规环境下的质量受权人业务提升和质量体系完善专题培训
11月18日每人500元收费(含餐)
特惠南京-2019PMEM药品生产及设备管理论坛
新药、仿制药的报批
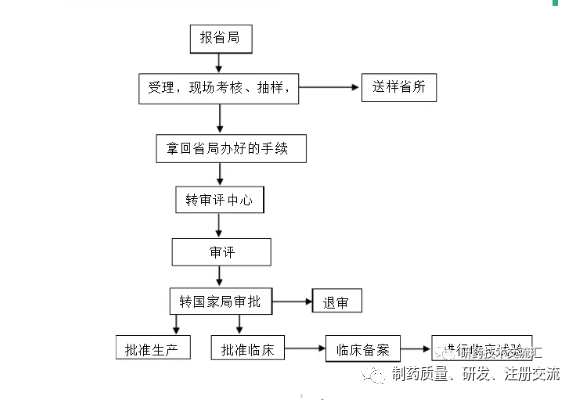
一、?报省局?
所有研究工作完成(有合格的样品、完整原始记录),带一套资料报往省局。[其中资料有:注册申请表(注册申报的要6、软盘(注册申请表、综述资料)、申报资料)?
1、?注册申请表要认真填写,是否属于非处方药、是否减免临床。版本应
是最新的(最新的版本很快就会出来,可在SDA网上下载)。?
2、?现受理权已下放到省局,5日内注册处人员告知你资料是否被退审,
若没,说明已受理。?
二、?现场考核、抽样?
现场考核(准备好样品、原始记录(含检验记录,批生产记录)、剪刀,胶衣、“信封”等)?
抽样(仿制药连续三批;新药一批)后,将药品抽样单、已封好的药品、一套资料报往省所,跟踪药品检验进度,交纳药检费,寄三份检验报告往国家局(省所办理)。?
三、?拿回省局初审的材料?
申请表、现场考核表、省局审查意见表、省局受理通知书?1、申请表的电子版需由省局的专用邮箱发往SDA。?
四、?报国家局审评中心?
该类申报资料国家局共需要2套完整的及1套第一部分,每套资料需要单独装袋。???
1、?第一套为原件(全部红章,化学原料药特别注意结构确证的图谱必须要由试验单位加盖红章)?
资料按下列顺序放置:?
药品注册申请表(2份)??现场考核表(1份)?
省局审查意见表(1份)??受理通知书?
软盘1份(可以进行网上提交)?申报资料1套?
2、?第二套为原件(全部红章,化学原料药结构确证的图谱可不加盖红章)资料按下列顺序放置:?
药品注册申请表(1份)??现场考核表(1份)?
省局审查意见表(1份)??受理通知书???申报资料1套?
3、?第三套为复印件?
资料按下列顺序放置:?
药品注册申请表(1份)???现场考核表(1份)?
省局审查意见表(1份)???受理通知书
申报资料的第一部分1套?
五、?审评?
1、?在cde.org.cn的网站上通过企业名称、受理号、受理日期跟踪药品的
审评进度。(如有补充资料,再对其补充)。?
2、?按CDE的要求制作药品说明书、标签、质量标准!(注:这阶段要非
常注意,不危害给药品上市会造成很大的麻烦。包装最好是多报几种规格,其可以在网上提交!)。?
六、?转注册司?
制作生产批件、临床批件或退审!(注:这阶段是最难等待的;往往临床秕件会让你痛苦。??或?)?
?附简单流程图:

仿制药的报批
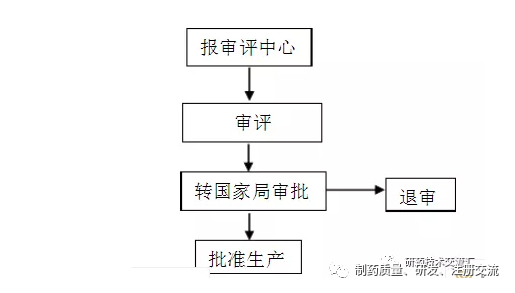
一、?固体制剂?
1、固体制剂(绝大部分)生物利用度做完后,整理出两份临床资料直接寄往国家局。?
第一套为原件(全部红章)、第二套可以是复印件?
资料按下列顺序放置:????临床批件?
临床样品的检验报告书?
长期稳定性资料(稳定性试验做得不长28、29、30、31、32号资料?
其他改变的资料(尽量不要变更)?
2、生物利用度资料提交完后,在cde.org.cn的网站上跟踪药品的审评进度。(如有补充资料,再对其补充)。?
3、按CDE的要求制作药品说明书、标签、质量标准!(注:这阶段要非常注意,不危害给药品上市会造成很大的麻烦。包装最好是多报几种规格)。?
4、注册司制作生产批件、退审!(注:这阶段是最难等待的;?或?)?
二、?水针之类的可以减免临床?
附简单流程图

新药的报批
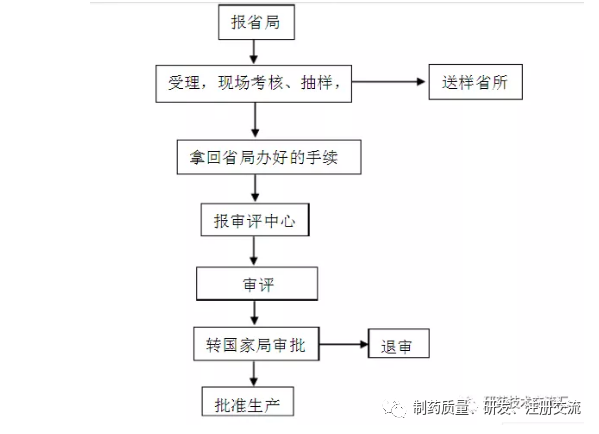
一、报省局?
所有研究工作完成(有合格的样品、完整原始记录),带一套资料报往省局。[其中资料有:注册申请表、软盘(注册申请表、综述资料)、申报资料]?
1、?注册申请表要认真填写,是否属于非处方药。版本应是最新的(可在
SDA网上下载)。?
2、?现受理权已下放到省局,5日内注册处人员告知你资料是否被退审,
若没,说明已受理。?
二、现场考核、抽样?
现场考核(准备好样品、原始记录(含检验记录,批生产记录)、剪刀,胶衣、“信封”等)?
抽样(连续三批)后,将药品抽样单、已封好的药品、一套资料报往省所,跟踪药品检验进度,交纳药检费,寄三份检验报告往国家局(省所办理)。?
三、拿回省局初审的材料?
申请表、现场考核表、省局审查意见表等?
1、申请表的电子版需由省局的专用邮箱发往SDA。?
四、报审评中心?
该类申报资料中心共需要2套完整的及1套第一部分,每套资料需要单独装袋。???
1、?第一套为原件(全部红章、试验单位加盖红章)?
资料按下列顺序放置:?
药品注册申请表(2份)????现场考核表(1份)?
省局审查意见表(1份)????受理通知书 软盘1份申报资料1套?
2、?第二套为原件(全部红章,试验单位可不加盖红章)资料按下列顺序放置:?
药品注册申请表(1份)?????????
现场考核表(1份)?
省局审查意见表(1份)?
受理通知书?
申报资料1套?
3、?第三套为复印件?
资料按下列顺序放置:?
药品注册申请表(1份)??
现场考核表(1份)?
省局审查意见表(1份)?
受理通知书?
申报资料的第一部分1套?交钱去吧!?
五、转审评中心审评?
1、在cde.org.cn的网站上通过企业名称、受理号、受理日期跟踪药品的审评进度。(如有补充资料,再对其补充)。?
2、按CDE的要求制作药品说明书、标签、质量标准!(注:这阶段要非常注意,不危害给药品上市会造成很大的麻烦。包装最好是多报几种规格)。?
六、转注册司?
制作生产批件、临床批件或退审!(注:这阶段是最难等待的;?或?)??
附简单流程图:
补充申请的申报资料?
一、报国家审批项,该类申请的申报资料报送国家局共2套,每套资料分别装袋。?
1、?第一套为原件(全部红章)?药品注册申请表(2份)?
现场考核表(1份,不需要现场考核的除外)?省局审查意见表(1份)?受理通知书?
省药检所的检验报告书(生物制品为中检所报告书,不需检验的除外)?软盘1份?申报资料1套?2、?第二套为复印件?药品注册申请表(1份)?现场考核表(1份)?省局审查意见表(1份)?受理通知书?
省药检所的检验报告书(生物制品为中检所报告书,不需检验的除外)?申报资料1套?
二、?报国家局备案的申报资料?药品注册申请表(2份)?省局批件1份。
免责声明:文章版权归原作者所有。如涉及作品内容、版权和其它问题,请跟我们联系删除!文章内容为作者个人观点,并不代表本公众号赞同或支持其观点。本公众号拥有对此声明的最终解释权。
点击“汇总表下方阅读原文”能直接报名!

最新更新!11-12月各部门培训标题链接汇总表
11月14-16日杭州新政下原料药制备工艺研究关键技术解析
12月6- 8日苏州医药、化工有机合成反应安全实践及 各类危险反应案例解析
12月 12- 14日南京2020版药典相关解读与各部难点实践分析
12月 13- 15日上海2019分析方法开发全实例培训
12月6-8日成都注射剂一致性评价疑难问题深度解析
12月5-7日苏州
药品注册管理办法变化解读和最新审评案例解析
11月29-12月1日上海2019制药数据管理-DI与CSV实践
12月3-5日s沈阳2019新药法下药品上市许可人制度实施策略
11月29-12月1日杭州2019新药法实施后取消GMP认证的监管趋势和重点变化解读
11月22-24日成都
2019注册专员国内外申报技能提升
11月28-30日杭州新法规下质量年度回顾、年度报告制度及工艺变更管理
12月5-7日上海2019药品研发质量体系建立与研发数据可靠性管控
11月14-16日上海2019杂质研究及基因杂质分析方法与策略
10月31-11月02日武汉2019新《药品管理法》实施解读专题培训
11月17-19日南京新法规环境下的质量受权人业务提升和质量体系完善专题培训
11月13-15日南京2019PIC组织关键指南深度解析”专题” 研修班
12月21-23日南京2019《药品生产监督管理办法》新旧对比及实施解读
11月8-10日上海2019药企如何避免被判定造假风险
11月7-9日北京2019《药品管理法》研发注册生产条款深度解读与实施关键点控制12月19-21日武汉微生物发酵菌种选育、改良及发酵工艺优化技术详解
11月15-17日北京2019质量QA岗位技能提升与完善专题培训
复制粘贴链接可手机在线报名:http://wb7l9dz7bx3u5yp7.mikecrm.com/eQrOYvR
点击下方“阅读原文”也可以直接报名