郑永侠 杜婧 杨悦 董江萍
摘要
国际药品检查组织 ( PIC/S) 是国际药品检查领域权威的机构 ,PIC/S 的检查标准已经成为国际药品生产管理规范 ( GMP) 检查的金标准和国际通行准则,国际上部分国家间基于 PIC/S 检查标准达成了检查互认协议 ( MRAs)。加入PIC/S 是实现我国多边 GMP MRAs 的需要,也是未来中国药品检查与国际接轨重要路径及实现国际间互认的重要基础。本文旨在通过对 PIC/S 的系列指南和相关文献的研究以及 PIC/S 国际专家的访谈,全面分析了 PIC/S 背景、使命以及架构和运行特点,重点介绍了 PIC/S 申请加入的要求和程序和对我国的启示 , 以期对我国药品检查工作的国际化发展提供借鉴。
关键词:国际药品检查组织(PIC/S);GMP;双边互认协议(MRAs)

药品监管是一种公共服务,是国家公共安全体系重要的组成部分。药品检查是药品监管的重要管理技术手段,广义来说,药品检查是指国家或省级药品监督管理部门为保证药品的安全性、有效性和质量稳定性,对药品研制、生产、流通等环节执行法律法规、质量管理规范、技术标准等情况进行调查处理的监管行为。国家或省级设立药品检查机构,其目的就是依据国家和省级职责和管理事权要求承担起药品检查任务的具体实施工作。
国际药品检查组织 (Pharmaceutical Inspection Co-operation Scheme,PIC/S) 是由各国药品检查机构组成的国际药品监管检查合作组织,聚焦 GMP 标准、检查机构质量管理体系和检查员培训体系的建立和执行统一,促进和推动监管机构在 GMP 相关领域的互信和交流,是国际药品 GMP 领域权威的组织机构,具有较高的国际影响力。本文通过对PIC/S 组织基本情况和申请程序的分析,提出了我国加入 PIC/S 的启示,以期对我国药品监管的国际化发展提供借鉴。

1 PIC/S 简介
1.1 PIC/S 的背景
1970 年欧洲贸易自由联盟 ( EFTA) 为消除药品贸易壁垒、促进药品 GMP 执行的协调统一,成立药品检查联盟 (Pharmaceutical Inspection Convention,PIC),签署了最早的药品GMP 检查双边互认协议(the Mutual Recognition Agreements, MRAs),随后匈牙利、爱尔兰、罗马尼亚、德国、意大利、比利时、法国和澳大利亚等 8 个国家也加入了 PIC[1]。至 1995 年欧盟成立,由于 PIC 受限于欧盟体系无法与其他国家签署协议,因而成立了相对 PIC 而言更加灵活的非政府性质的国际组织PIC Scheme(表 1)。如今 PIC 和 PIC Scheme 并行运作,合称 PIC/S,持续致力于促进 GMP 的国际交流合作和检查标准统一。

1.2 PIC/S 的使命和成员
PIC/S 的使命是引导药品领域统一的 GMP 标准和检查机构质量体系的建立、执行和维持。主要通过制定和推广统一的 GMP 标准和指南、培训监管机构特别是 GMP 检查员、GMP 检查机构的评价和再评价以及促进与监管机构和国际组织的交流合作等一系列措施来实现这一使命。
PIC/S 旨在通过制定统一的 GMP 标准和为培训检查员提供培训机会协调全球药品检查标准,促进 GMP 交流合作,增加检查机构互信,促进 GMP 发展、MRAs 和统一。对于 PIC/S 成员,要求其采用与 PIC/S 要求等同的 GMP 检查体系,保证 GMP 检查体系的执行和交流合作,同时成员的检查体系要以 PIC/S 联合评价项目为基础进行再评价,不断完善和提高 GMP 检查体系,保持高水平 GMP 标准。
PIC/S 目前共有 52 个成员 ( GMP 检查机构 ), 分属于 48 个国家及地区,另有 4 个合作组织 [2](表 2)。

1.3 PIC/S 架构及运行
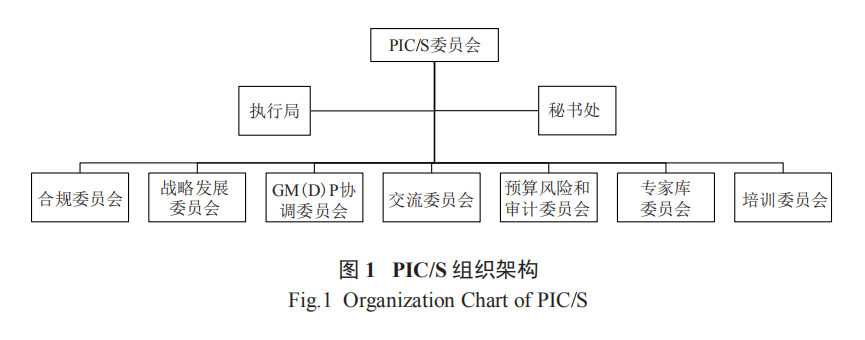
PIC/S 由委员会 (Committee,CO)、执行委员会 (Executive Bureau,EB) 和秘书处组成 ( 图 1),CO 是 PIC/S 的决策机构,由成员代表组成,CO 下设 7 个执行委员会和多个专家工作组,重要职能是修改 PIC/S 章程,决定新成员的加入以及更新或制定 GMP 相关法律法规或指南。标准 PIC/S 委员会会议每年召开 2 次,通常在每年的 5 月和 10 月举行,该会议最重要的一项议程是决定新成员的加入。国际组织的代表可被邀请作为观察员列席委员会会议,委员会也可邀请申请加入的检查机构的检查员作为观察员参加会议。EB 是执行机构,由主席、副主席、7 个执行委员会主席和秘书组成,主要负责 CO 的日常工作,必要时可在委员会间歇期召开会议,执行和监督委员会的决定、计划和建议。秘书处负责协助 CO 和 EB 工作 [3]。
2 PIC/S 申请加入程序
由于各国医药产品 GMP 规定差异众多,相关检查机构的质量体系不同,PIC/S 评估新成员资源有限,同时为使申请程序更加便捷高效,PIC/S 申请加入程序分为“预申请”和“正式申请”两个阶段。PIC/S 委员会是决定新成员加入的主要决策机构,通常需在委员会会议前 1 个月提出申请。
2.1 评估指标
PIC/S 评估申请机构使用的评估指标是全球药品检查机构通用评估工具——PIC/S检查清单[4]( PIC/S Audit Checklist),其最先由欧盟 - 加拿大MRAs 提出,在 MRAs 期间用于评估欧盟所有检查机构和加拿大卫生部。检查清单是对整个检查体系进行全面的评估,包括法律法规的要求与范围、法规指导与政策、GMP 标准、检查资源、检查程序、检查执行标准、执行能力和程序、预警和危机系统、分析能力、监督计划、质量管理体系等 11 个板块,38 个亚板块,78 个具体指标,每个指标采用 1 个或多个评估方法,包括文件评估 ( documentation review, DR)、检查机构现场评估 (on-site evaluation at inspectorate , OSEI)、实验室现场评估 ( on-site evaluation at laboratory,OSEL)、观察检查 (observed inspections,OI)等 4 种评估方式。
2.2 预申请程序
2.2.1 条件和要求
对于未采用 PIC/S GMP 指南、尚未定期参加PIC/S 培训、不确定是否符合 PIC/S 要求、未采用PIC/S 推荐的质量体系或主动提出预申请的国家监管机构,PIC/S 推荐启动预申请程序。预申请机构首先需要向 PIC/S 秘书处提出申请,完成《评估调查问卷》[5],完成检查清单并提供证明性材料,但相关材料只是作为参考,只需提供文件列表即可。秘书处将预申请程序、期限等信息提交 PIC/S 委员会。
预申请最长期限是自收到完成的调查问卷之日起 2 年。预申请属于自愿评估过程,没有申请费, 预申请机构每年可自愿交纳 50%成员年费,用于参加非限制性的委员会会议和获得 PIC/S 内部文件。
2.2.2 评估方式
预申请评估的主要方式是文件评估。PIC/S 委员会指定 1 名报告员 ( rapporteur)和 1 名联合报告员 (co-rapporteur)( 必要时),审查预申请机构根据检查清单提交的相关文件、法律法规、质量体系等与 PIC/S 基本要求是否存在重大差距,必要时对预申请机构进行现场评估 (on-site assessment) 并完成差距分析。完成差距分析后,报告员撰写差距分析报告提交 PIC/S 委员会进行审查,PIC/S 委员会根据差距分析报告,建议预申请机构正式申请加入或要求预申请机构进一步改进以满足 PIC/S 要求 [6]。预申请相当于模拟正式申请,主要是进行差距分析,指出与 PIC/S 要求不相符的领域,以便申请机构及时纠正改进,因此通常能够帮助申请机构快速加入PIC/S。
2.3 正式申请程序
当申请机构完成本国检查体系与 PIC/S 要求的差距评估和 / 或预申请成功后,检查机构可以提出申请加入 PIC/S。申请机构以书面形式向 PIC/S 秘书处提出正式申请,完成《评估调查表》和检查清单。与预申请不同的是,正式申请需要对检查清单中的指标提供详细证明性文件。秘书处初步审查提交的申请和相关文件是否符合要求,若符合,将要求申请机构支付申请费,并通知 PIC/S 委员会任命报告员对申请机构进行评估 ;若不符合,则将申请材料退回申请机构。
正式申请流程主要分为申请机构提出正式申请、文件评估、现场评估等,详细流程见图 2。已开展预申请的机构,文件评估和现场评估一般较快。
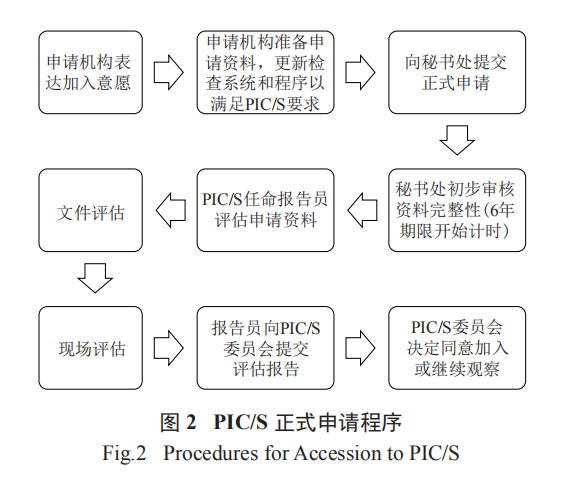
根据申请机构的规模和复杂程度以及申请材料的数量,PIC/S 委员会任命 1 名报告员和 1 名或几名联合报告员审查申请资料。合规委员会主席或执行局其他成员可以向委员会推荐报告员和联合报告员,由委员会最后决定。
正式申请的评估采用文件评估和现场评估相结合的方式。文件评估主要是评估申请材料,如果申请机构没有进行预申请,则报告员将对申请材料进行快速评估,如有疑问或申请机构不符合 PIC/S 要求,则要求申请机构先进行预申请。报告员应在委员会会议前 1 个月将评估进展报告送秘书处。
现场评估主要是对申请机构及其实验室的现场评估以及观察多家生产企业的现场检查情况。现场评估由委员会任命的 5 ~ 6 人检查组对申请机构的检查系统、检查标准和检查方法进行评估,并评估检查员的现场检查能力和检查操作程序。观察检查主要是对申请机构的 GMP 检查员的能力和水平进行评估,不会对被检查企业开展检查 [7]。报告员现场检查准备一般需要 12 个月并需提交 PIC/S 委员会,现场检查通常需要 1 周左右,通常第 1 天审查申请机构质量体系、SOPs、相关法律法规等,第 2、3或 4 天观察 3 个典型 GMP 检查,其中第 2 天观察国家检验实验室,第 5 天继续审查申请机构检查系统和检查程序并反馈、总结。具体现场检查日程见表 3。

在过去 5 年中,申请机构已经参加过 PIC/S 成员中其他项目的评估或再评估,PIC/S 委员会可基于报告员对上述参与机构出具的评估报告的审查确定进行局部评估 [6]。正式申请有 6 年期限,申请超时需要重新提交申请。正式申请过程中,申请机构每年需缴纳注册费 8 100 瑞士法郎和 50%成员年费 [8]。
2.4 申请所需时长
理论上,申请者在申请提交后 18 个月可以成为 PIC/S 成员,最长期限是 6 年但是允许中间暂停12 个月。但从部分国家申请加入 PIC/S 的经验来看, 多数需要花费大约 3 ~ 5 年才能通过评估成为 PIC/S 成员(表 4),这主要是因为 PIC/S 评估是系统、全面的过程,评估整个 GMP 检查体系要素和程序的耗时较长,且 PIC/S 委员会通常只在每年的 5 月和 10 月的委员会会议上审议加入申请。绝大多数国家进行了 2 次申请才最终加入 PIC/S,评估过程中出现的问题主要为 GMP 相关要求与 PIC/S 不等同、检查员培训不充分、检查程序不完善、质量体系和检查绩效评估存在不足等。

3 对我国的启示
PIC/S 自成立以来始终以建立统一的 GMP 标准和质量体系、促进检查机构在 GMP 领域的互信合作为使命,成为了国际药品 GMP 检查的权威组织,检查标准已成为全球药品监管机构在药品检查领域的金标准和国际通行规则,基本上发达国家和地区均是其成员。相关国家基于 PIC/S 标准拟定了GMP 检查 MRAs,如欧盟与澳大利亚、加拿大、日本、以色列、新西兰、瑞士、美国 ( 更新中 ) 等签订了MRAs[9],澳大利亚 TGA 与奥地利、法国、列支敦士登、西班牙等 25 个国家签署了 GMP 认证相互认可协约 [10],同时,一些国际卫生组织如 WHO、全球抗击艾滋病、结核和疟疾基金会等认为 PIC/S 是严格的监管机构,认可 PIC/S 成员批准上市的药品, 列入药品采购考虑范围。
3.1 加入 PIC/S 是实现我国与发达国家和地区实现互认的重要基础
随着全球药品供应链的不断延长和日趋复杂化,各国药品监管部门都面临监管范围内的进口产品数量急剧增长、种类日益复杂和检查资源有限带来的严峻挑战 [11]。GMP 检查互认逐渐成为国际药品检查的新路径 [12],如统一标准下达成共识并进行约定,检查结果的互认能够避免重复检查,大大降低检查成本,同时将有限的资源更多地投入到高风险产品和关注高风险地区。美国 FDA 面对检查资源的有限性与进口产品数量和种类的快速增长的矛盾,与欧盟启动 FDA-EU 药品检查 MRAs,互认药品 GMP 检查结果,2017 年 11 月,欧盟和美国的 GMP 检查互认协议进入正式实施阶段,欧盟成员国和 EMA 可依赖 FDA 的检查结果,并预计2019 年 7 月 FDA 将完成对所有 28 个欧盟成员国的评估。届时 FDA 将停止对通过检查能力评估的成员国制药企业的日常设施检查,并将依赖各国的检查数据 [12]。日本和欧盟、美国也达成了原料药检查互认的协议 [13]。
目前,我国虽然对药品生产企业实施 GMP 已20 余年,但现行版 GMP 与大多数国家尤其是发达和重要的发展中国家尚未达成互认,这在很大程度上影响了我国药品监管的国际的影响和医药产品进入国际市场的进程。因此加入 PIC/S 是实现我国多边 GMP MRAs 的需要,也是未来中国药品检查与国际接轨的重要路径。
3.2 按照 PIC/S 标准和要求,加快我国 GMP 检查体系完善与检查能力的提升
PIC/S 高准入门槛,使用的评估指标是全球药品检查机构通用评估工具——PIC/S 检查清单,同目前世界卫生组织国家监管能力评估中的监管检查指标体系一脉相承,要求申请加入的监管机构采用与 PIC/S 要求等同的 GMP 检查体系。因此现阶段, 我国需要深入研究并全面掌握与国际通行检查规则——PIC/S 要求的差距。
2017 年至 2018 年,国家食品药品审核查验中心在比尔盖茨基金项目的支持下,聘请 5 位国际药品检查专家参照 PIC/S 评估指标体系先后开展了江苏、山东、河南和上海等 15 个省 ( 市、自治区 ) 的省级药品检查机构 GMP 检查体系评估工作。国际专家对于我国省级检查机构存在的主要问题总结为 :目前各省承担所在地的监管职责,省级专业化检查员数量与医药产业规模不匹配、专职化程度不高 ;监管检查类型不统一 ;检查程序有待改进,重点关注如何基于风险制定检查计划,需要给予检查员充足的时间准备检查,以及建立对检查活动的绩效评估机制 ;检查员培训体系欠完善,主要表现在培训数量不足,没有明确界定培训需求,以及对培训效果的评估不完善 ;尚未建立全系统的检查信息共享机制。同时专家建议,上述问题整个药品检查体系都应关注,国家药品监管部门也要从更高层面统筹规划协调。因此,下一步需要针对这些问题在国家层面全面加以规划指导进行改进和提高,完善我国 GMP 检查体系并与国际检查标准接轨。
3.3 加强接触,让国际社会深入全面了解中国药品监管
从 PIC/S 引导和建立全球统一的 GMP 标准和检查机构质量体系可看出,PIC/S 积极邀请尚未加入的国家加入,以增加 PIC/S 的国际代表性和影响力。PIC/S 发布《2019 年工作计划》第 10 条提到中国药监局 (NMPA) 表示有兴趣加入 PIC/S[14]。我国可以首先加强与国际组织和相关国家的接触,让国际社会深入全面了解中国药品监管与国际趋同的发展现状,可以寻求首先以观察员的身份参与 PIC/S 活动,等时机成熟后,按照 PIC/S 申请加入程序准备进行预申请和正式申请等程序,最后再正式提出申请加入 PIC/S。
4 结论
PIC/S 作为药品检查技术标准领域最权威的机构,在国际药品监管领域具有很强的国际影响力。随着全球药品供应链的日益复杂化,互相依赖彼此检查结果,实现国际药品 GMP 检查结果的 MRAs 成为了国际药品检查发展的必由路径。部分国家基于 PIC/S 检查标准建立了检查互信协议,进一步完善我国 GMP 检查体系,提高检查能力和水平,达到 PIC/S 要求是实现我国多边 GMP MRAs 的需要, 也是我国药品监管与国际接轨的重要基础和前提之一。

参考文献:
[1]PIC/S.PIC/S Introduction [EB/OL].https://picscheme.org/en/about.
[2]PIC/S.List of PIC/S Participating Authorities [EB/OL].https://picscheme.org/en/members.
[3]PIC/S.Organisational Structure [EB/OL].https://picscheme.org/en/organisational-structure.
[4]PIC/S.Audit Checklist [EB/OL].[2014-10-20].https:// www.picscheme.org/en/publications.
[5]PIC/S.Questionnaire for Assessment [EB/OL].[2011-07- 22].https://www.picscheme.org/en/publications.
[6]PIC/S.Accession Procedure [EB/OL].https://www.picscheme.org/en/accession-procedure.
[7]PIC/S.Guideline for Accession [EB/OL].[2014-01- 09].https://www.picscheme.org/en/publications.
[8]PIC/S.Guidelines for Accession to the Pharmaceutical Inspection Co-operation Scheme [EB/OL].[2014-01- 09].https://picscheme.org/en/publications.
[9]EMA.Mutual recognition agreements(MRA) [EB/OL]. [2019-03-09].https://www.ema.europa.eu/en/ human-regulatory/research development/ compliance /good-manufacturing-practice/mutual-recognition-agreements- mra.
[10]翁新愚, 陈玉文, 毕开顺.国外药品GMP检查及收费标准探讨[J].中国新药杂志, 2012, 21(22): 2604-2607.
[11]范琳琳, 梁 毅.FDA-EU药品检查互认协议的推出对我国制药企业的影响[J].中国医药工业杂志, 2019, 49(2): 229-232.
[12]EMA.Two additional countries to benefit from EU-US mutual recognition agreement for inspections[EB/OL]. [2019-02-11].https://www.ema.europa.eu/en/news/ two-additional-countries-benefit-eu-us-mutual-recognition- agreement-inspections.
[13]PMDA.PMDA joins International program to rationalize GMP Inspections of API manufacturers [EB/OL].[2016- 11-25].http:// www.pmda.go.jp/ english/ about- pmda/0005.pdf.
[14]PIC/S.PIC/S Work Plan for 2019 [EB/OL].[2019-01- 01].https://picscheme.org/en/picscheme.
文章来源:
郑永侠,杜婧,杨悦,等.国际药品检查组织(PIC/S)申请加入程序及对我国的启示[J].中国医药工业杂志,2019,50(9):1059-1064.


转载此文请联系“国际药政通”(SYPHU-IFDPL),并保留出处。


责任编辑:崔力
