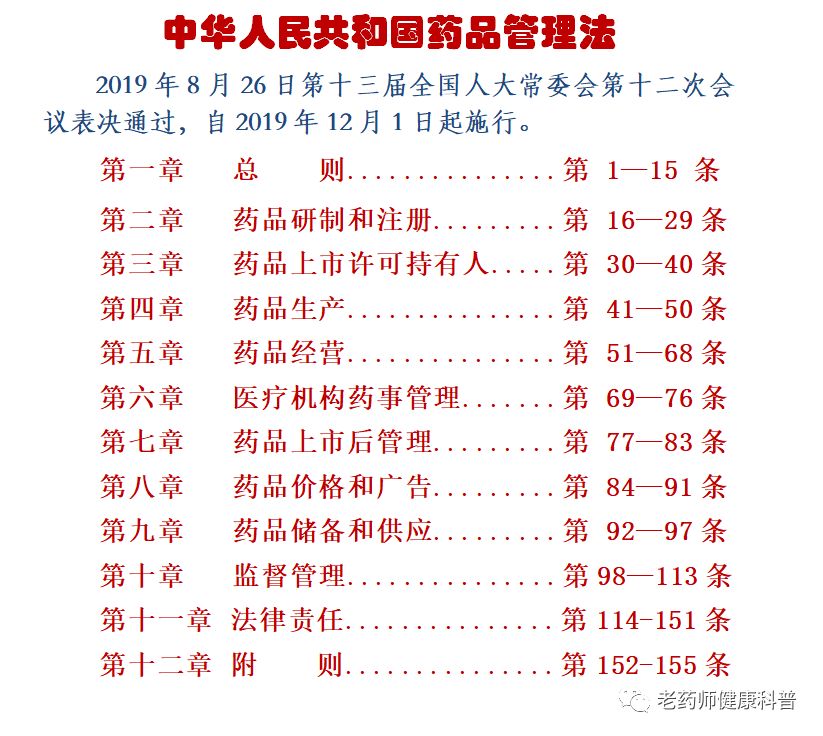
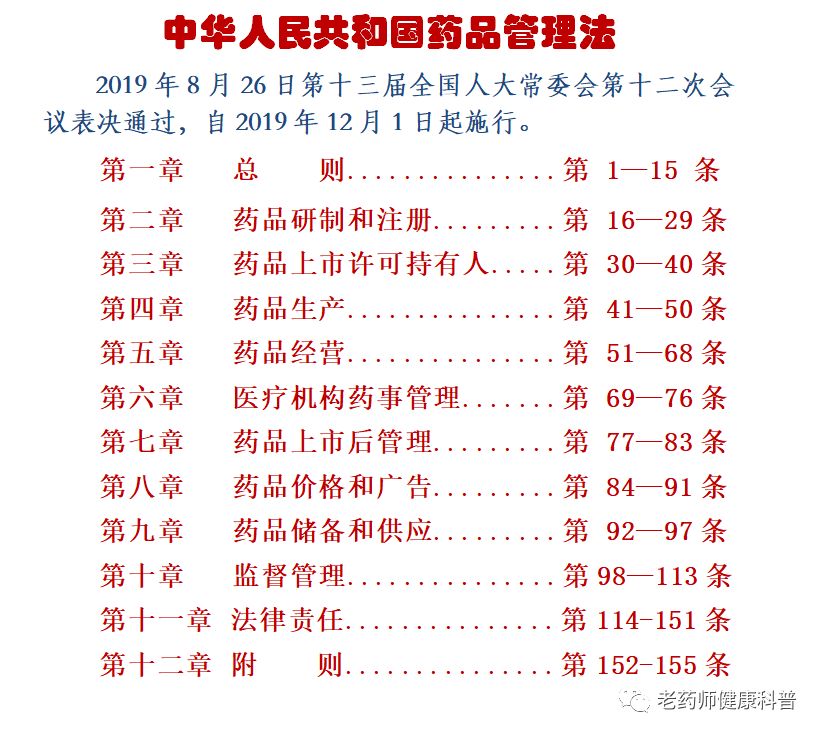
《普法宣教版“药品管理法”》第6-7章
阅读量:3739814
2019-10-24
编写说明
药品涉公众,普法责任大
一百五十五,条条口语化
法言术语多,未能信雅达
不求完整现,精神实质抓
为防歧义出,法条随附发
仅供助学习,真格别提它
普法宣教版“药品管理法”
作者:车明凤2019年10月23日
《普法宣教版“药品管理法”》第1-3章
《普法宣教版“药品管理法”》第4-5章
第六章 医疗机构药事管理
第69条
医疗机构里,应配药管家,
非药技人员,不得把药抓,
药师技术员,资格应合法。
药品的管理,处方的核查,
药剂的调配,合理用药法,
指导应到位,全院统管辖。

第70条
医院购药品,进货应验查,
合格等标识,不符得拒纳,
制度定明确,执行落实达。

第71条
医院内药品,保管制度化,
软硬件环境,均须适宜它,
冷藏防冻潮,虫鼠不得达。

第72条
安全和有效,经济适宜化,
用药之原则,指南说明卡,
药师审方责,必须履行达。
用药各单位,应当遵本法,
临床技术规,助医把脉把,
获益与风险,平衡合理化。

第73条
药师技术员,资格应合法,
调配医处方,核对加检查,
更换或替代,一律禁止化。
配伍有禁忌,剂量超定法,
应当拒调配,原路退回它,
更正或重签,再配方合法。

第74条
配制药剂前,许可证先拿,
省级药监局,负责把证发,
无证配制药,发现将重罚。
制剂许可证,剂型明码加,
有效期明载,到期须换发,
换发非过场,条件重审查。

第75条
制剂的配制,应当规范化,
设施制度适,检验能力达,
软硬件环境,保证质量佳。
核准之工艺,不得有变化,
原料辅料等,包装材料加,
质量合药用,来源可溯查。

第76条
医院之制剂,品种审批化,
市场无供应,临床需要它,
省级药监局,负责把关卡。
制剂应检验,合格方合法,
医师开处方,凭方把药发,
仅供本院用,不得上市贾。
医院间调剂,须经批准划,
本地调剂用,省级统管辖,
跨区域调剂,国家批准达。

第七章 药品上市后管理
第77条
许可持有人,履责持续化,
药品的风险,管理定计划,
上市后研究,“三性”确证达。

第78条
附条件药品,风控应强化,
相关诸研究,须按期完达,
获益不明确,依法注销它。

第79条
生产之变更,管理分类划,
报告或备案,重大审批法,
“三性”影响大,批准方上马。
许可持有人,依规把关卡,
变更之影响,评估验证达,
安全和效质,证据均须拿。

第80条
许可持有人,监测责任大,
收集和跟踪,分析识别达,
不良反应明,风控及时抓。

第81条
质量与疗效,不良反应加,
许可持有人,生产经营家,
医疗机构等,考察常态化。
用药出异常,报告及时发,
问题严重药,全链条下马,
药监和卫健,共定管理法。
不良反应重,紧急管控达,
五日内鉴定,结论明确化,
依法作裁定,十五日内发。

第82条
许可持有人,风控应履达,
质量有问题,安全隐患大,
产销用全停,报告及时发。
已售须召回,信息公开化,
生产和经营,医疗机构加,
省级药监局,可把责令下。

第83条
许可持有人,主体责任大,
药品之“三性”,定期作评价,
国家药监局,可把责令发。
自评或国评,三类应下马,
疗效不确切,不良反应大,
其他危害存,应当注销它。
已注销药品,全面禁止化,
产销进口停,使用亦违法,
超效期药等,销毁处理达。

编写说明
药品涉公众,普法责任大
一百五十五,条条口语化
法言术语多,未能信雅达
不求完整现,精神实质抓
为防歧义出,法条随附发
仅供助学习,真格别提它
车明凤,2019年10月22日
往期相关文章
《普法宣教版“药品管理法”》第1-3章
《普法宣教版“药品管理法”》第4-5章
药品立法步步高
中华瑰宝放光芒
原创不易,如果觉得不错,请点个“在看”哦!