导语

安翰科技将人工智能技术应用于小肠疾病的临床识别,取得突破性进展。该研究成果文章 Gastroenterologist-Level Identification of Small-Bowel Diseases and Normal Variants by Capsule Endoscopy Using a Deep-Learning Model(译名《使用深度学习模型的胶囊内窥镜对小肠疾病和黏膜正常改变的胃肠病专家级临床识别》)[1]于 2019 年 10 月作为封面文章在国际消化领域顶级期刊 Gastroenterology(译名《胃肠病学》,影响因子 19.233,RANK = 1)上发表,标志着消化内科又添新助手,有望极大程度地改变小肠疾病的诊断模式,为临床医生与患者带来福音。

消化内科又添新助手 人工智能算法可大幅提升阅片时间
最近,深度学习算法在医疗领域的应用备受关注。据报道,一种基于深度学习的人工智能(AI)模型在皮肤癌分类方面的表现与皮肤科医生相当。[2]此外,深度学习模型在结肠镜检查图像视频中实时鉴别腺瘤性和增生性小型结肠息肉的能力也已经得到验证。而本文中关于小肠疾病识别的临床研究,也正是基于深度学习的AI模型来区分异常图像和正常图像。[3]
《使用深度学习模型的胶囊内窥镜对小肠疾病和黏膜正常改变的胃肠病专家级临床识别》一文由华中科技大学同济医学院附属协和医院侯晓华教授、蔺蓉教授团队研究,第一作者为华中科技大学同济医学院附属协和医院消化内科丁震教授、施慧英医师。由于安翰科技在胶囊内镜数据影像数据分析以及深度学习模型研究、深度学习算法实现上为这篇论文做出了重要贡献,安翰科技的3位技术专家作为该文章共同作者出现。
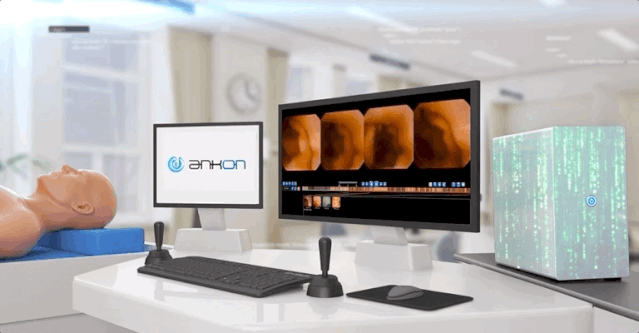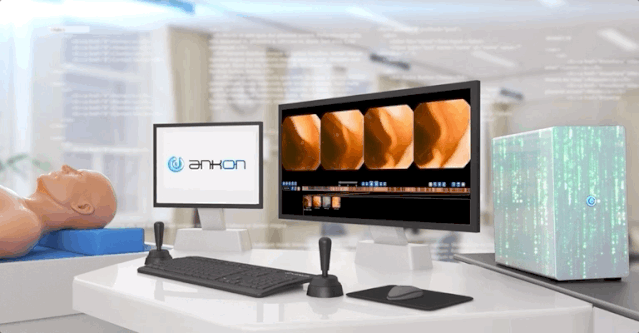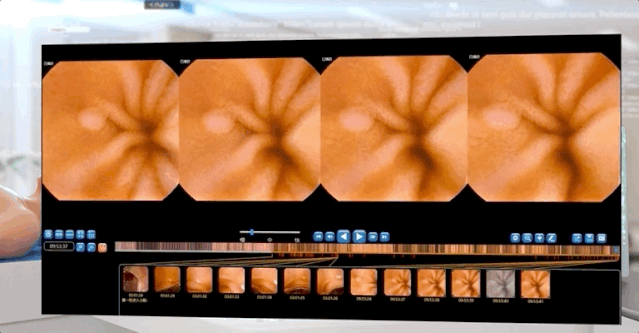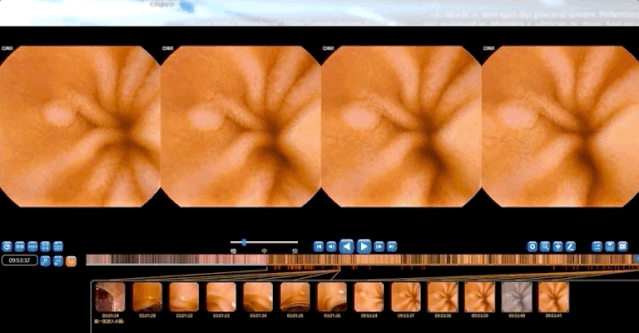
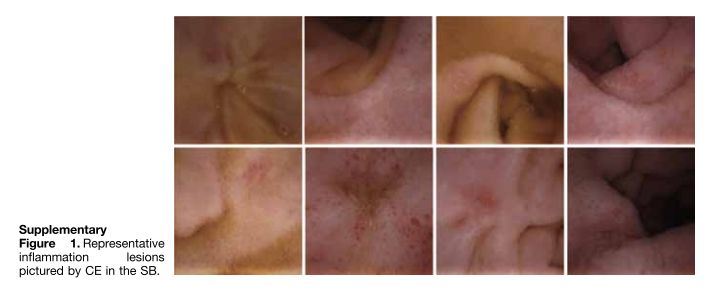
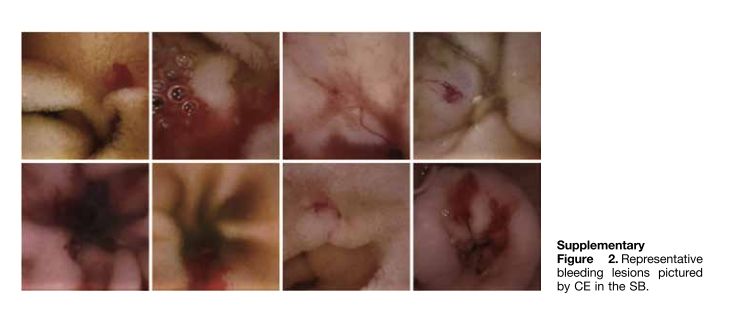
左右滑动查看更多
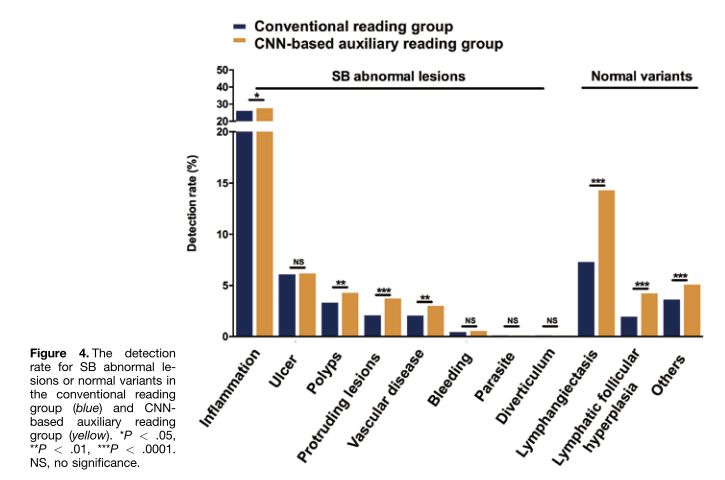
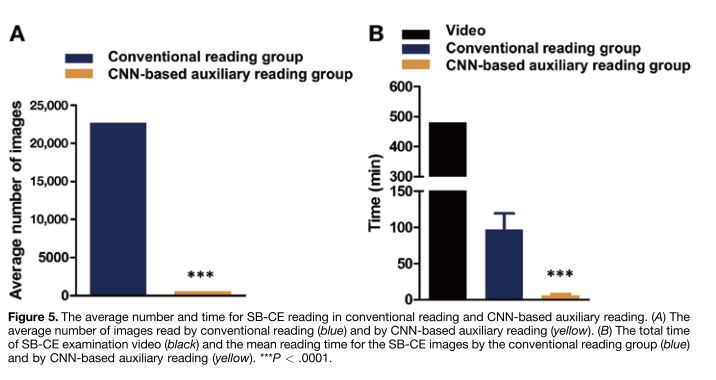
不同于传统应用的胃镜及肠镜,小肠疾病是传统内镜和影像学检查的难点,胶囊内镜的应用是小肠疾病的重要诊疗方式。然而,由于每例小肠胶囊内镜检查产生的视频时长长达8-10个小时(平均20000-30000张采集图片/例),每例患者将花费消化内科医生1-2小时的时间逐一分析数据和诊断疾病,这大大增加了消化科医生分析和诊断小肠疾病的时间成本。同时,高强度的人工读片也会增加漏诊率,大大限制了胶囊内镜在小肠疾病临床检查中的广泛应用。安翰科技人工智能技术的应用,基于CNN的算法将小肠胶囊内镜的读取时间缩短了93.9%,为5.9分钟,有效辅助消化内科医生诊断小肠胶囊内镜图像。
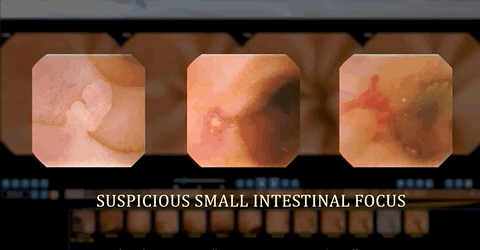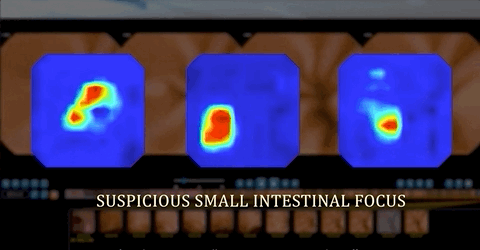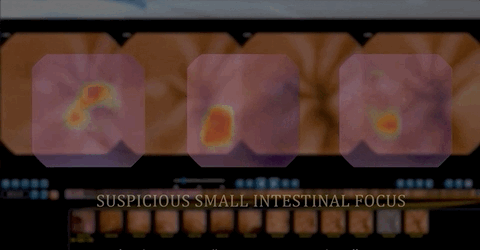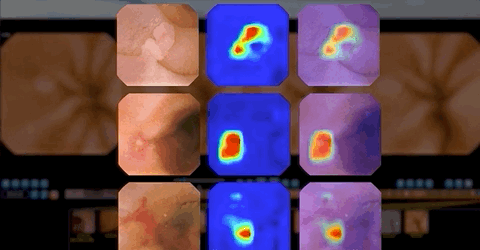
人工智能训练可提高检出率 挽救病人生命
该项研究使用安翰科技ESView平台在77个医学体检中心进行,患者均行安翰磁控胶囊内镜检查。该系统由三部分组成:胶囊内窥镜、数据记录仪和带有实时查看和控制软件的计算机工作站。
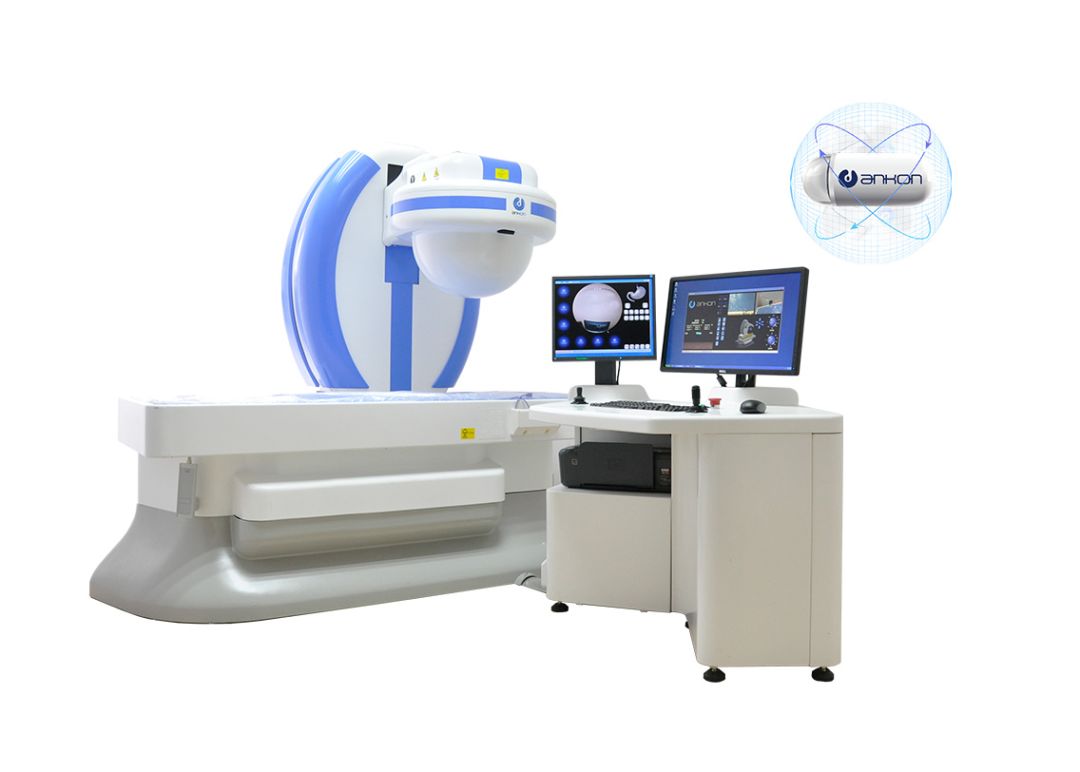

安翰胶囊内窥镜长27毫米,直径11.8毫米,重4.8克,视野大于140°±10%。胶囊自由通过小肠,动态帧速率为0-2帧/秒。图像以0.8帧/秒的平均速度被捕获和记录。每个视频都是由连续的单个图像/帧组成。视频中的每一幅图像或每一帧都被按图像拍摄的顺序标记上一个特定的数字,保存到一个文件夹中。
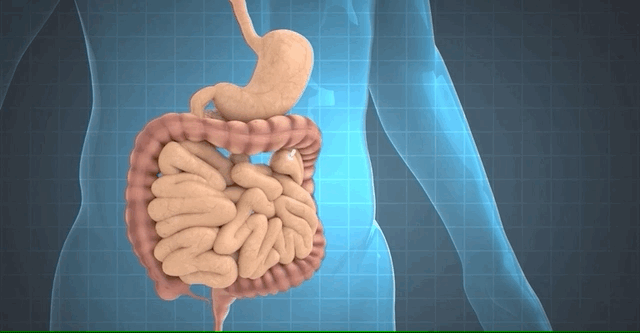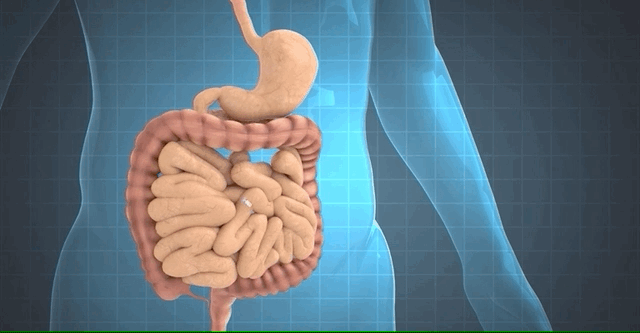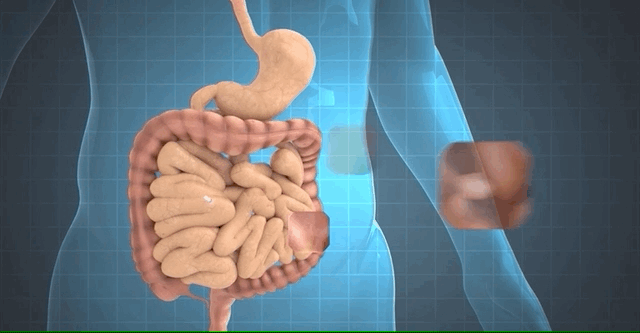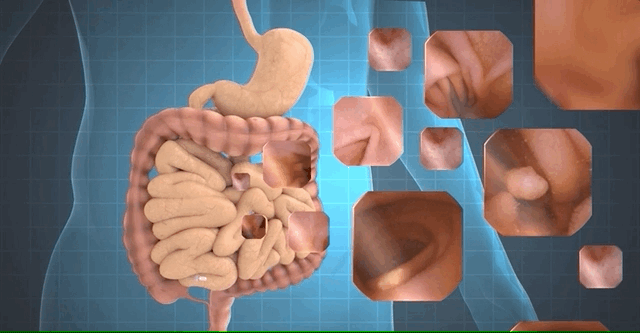
该研究收集2016年7月至2018年7月期间6970名患者的小肠胶囊内镜检查图片113,426,569张图像,分别通过常规方法阅片、深度卷积神经网络(CNNs)的人工智能图像辅助阅读模型。在CNN模型训练阶段,研究人员使用1970例患者的小肠检查图像建立模型;在模型验证阶段,用5000例患者的小肠检查图像验证模型。
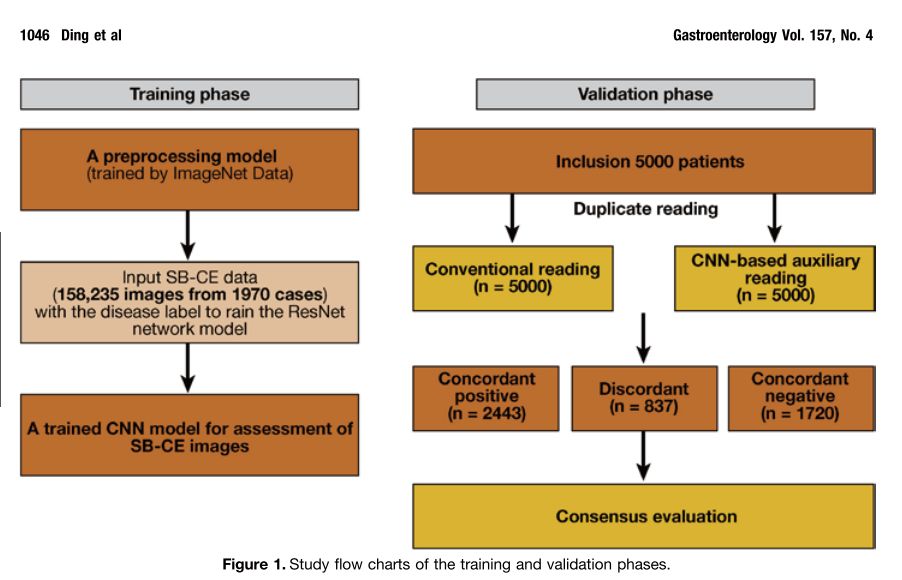
基于深度卷积神经网络辅助阅片模型的验证阶段:在验证阶段,所有5000份记录( 113,268,334张图像)均由20 名经常进行小肠胶囊内窥镜(SB-CE)检査和评估的消化内科医生通过传统阅片和基于CNN的辅助阅片进行诊断。
对于传统阅片,5000名患者的5000个视频全部由20名消化内科医生组成的团队阅片。这些视频随机平均分配给 20名消化内科医生,每名消化内科医生收到250WH 视频。消化内科医生审阅每个视频中的所有原始图像。对于基于 CNN辅助阅片,首先将5000例患者的所有原始胶囊内窥镜检查图像输入到基于CNN辅助阅片模型中,并由消化内科医生对模型自动过滤的可疑异常图像进行人工复査。可疑异常图像 采用训练阶段描述的基于CNN辅助阅片模型进行选择。所有消化内科医生独立诊断自己分到的250患者并记录诊断结果和阅片所用的时间。
当传统阅片和基于CNN辅助阅片之间达成诊断一致时,则不需要进行进一步的评估。如果最终诊断不一致和/或观察到不同的病变时,20名消化内科医生坐在一起,共同对患者的图像进行重新评估,以确认或排除不一致。仅以最终一致诊断作为诊断的参考标准。对于传统阅片识别 的病灶未被基于CNN辅助阅片检测到,我们通过检査CNN 辅助阅片模型自动筛选出来的可疑异常图像,以确定基于 CNN辅助阅片模型是否未检测到病灶。对于CNN辅助阅片 识别的病变未被传统阅片识别到,我们则重新检査经CNN 辅助阅片识别的疑似异常图像和该患者的原始视频。对于一个特定的病人来说,由于CNN辅助阅片模型自动筛选出来的可疑异常图像都会被特定标记,所以很容易在原始视频中追踪到该病变所在的位置。
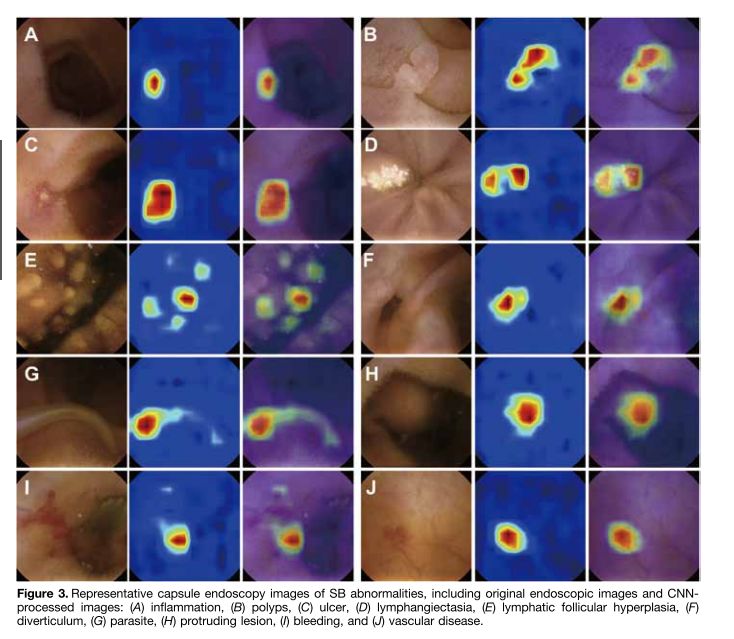
值得一提的是,基于CNN的辅助阅片系统设计的目的是为了确保最高的灵敏度,即筛查出尽可能多的病变,研究者将小肠检查图像分为正常图片和异常图片。异常图片在这项研究中又被定义为两个不同的类别:具有临床意义的显著异常病变(如炎症、溃疡、息肉、隆起性病变、血管疾病、出血、寄生虫和憩室)和轻度异常病变(淋巴管扩张、淋巴滤泡增生等)。
安翰科技将人工智能技术应用于小肠病灶筛查,不仅实现了胶囊内镜应用的智能辅助,更有望极大程度地改变小肠疾病的诊断模式,开启小肠疾病诊断新纪元,具有重大的临床和社会价值。未来也将尝试验证该算法在其他类型胶囊内镜检查中的应用,为临床医生与患者带来福音。
参考文献

1. Gastroenterologist-level Identification of Small Bowel Diseases and Normal Variants by Capsule Endoscopy Using a Deep-learning Model[J].,,:.
2. Esteva A, Kuprel B, Novoa RA, et al. Dermatologist-level classification of skin cancer with deep neural networks. Nature 2017;542:115-118.
3. Byrne MF, Chapados N, Soudan F, et al. Real-time differentiation of adenomatous and hyperplastic diminutive colorectal polyps during analysis of unaltered videos of standard colonoscopy using a deep learning model. Gut 2019;68:94-100.
点击下方“阅读原文”查看更多↓↓↓