

▲10月底,同写意将在苏州金鸡湖畔举办15周年全球生物技术前沿千人大会,汇聚近200位新药领军人物,点击查看详细日程。
「目录」
点击蓝色链接查看前情提要
一、口服药物递送系统之十年进展(上)
引言
片剂
胶囊
二、口服药物递送系统之十年进展(中)
肠贴片
微针贴片
离子液体
水凝胶
三、口服药物递送系统之十年进展(下)
纳米系统
未来前景

翻译 / 意药同萌 @林药师 @Amiee @萌皛溪 @路路
编辑 / 同写意 @annie
本文共计2007个字,预计阅读时间需要3分钟。
本文是系列文章之最后一篇,前两篇内容点击目录中的蓝色链接即可查看,感谢关注。
本文是同写意原创作品,转载请在后台回复“转载”。
先进的药物递送系统可以赋予药物新的处方及给药途径,有助于延长药品的生命周期及发明人对产品的垄断。

这些年来,药剂学研究已经从单纯的药品生命周期管理转变到对药物的再利用:应用递送技术去解决药品研发早期的溶解性和组织渗透性难题,或是解决在药物研发的晚期出现的安全性和有效性难题。
虽然药物和疾病的特点是给药途径选择的首要考虑,然而口服给药,因为它的耐受性和安全性,是最受欢迎的给药途径,特别是对于慢性病,包括疼痛(疼痛不被视为疾病,而是一些疾病的一种主要症状)。
因此,本综述的目的是总结口服给药技术在注射-口服转化中的应用进展,改善现有口服给药系统的风险-效益曲线,并将其应用于早期发现计划中,以降低药物损耗率。
纳米系统
除静脉途径给药外,常规的递送系统是在规定时间内,在体内特定部位释放药物(例如:片剂、胶囊、贴剂、凝胶在肠道释放),药物亦从该部位开始吸收。
口服给药仍然是药物递送的首选途径,但由于药物黏膜渗透性低、在胃肠道区域渗透受限、溶解度或稳定性低以及消除降解等原因,许多药物的生物利用度差(Tibbitt等人,2016)。
纳米药物递送系统,由于尺寸微小,能够在体内亚细胞水平发挥作用,这具有新的临床前景(Langer和Weissleder,2015)。
在胃肠道转运期间,由于是整个颗粒形式被完整的吸收,据认为所包埋的药物受保护免于被胃肠道环境降解。
纳米粒胃肠道摄取的首要部位似乎是Peyer斑的淋巴上皮M细胞,因为已经证明微粒滞留在Peyer斑块中,而纳米粒则是全身分布(Jani等,1990)。
假设纳米颗粒与M细胞的顶膜结合后,会发生內吞和穿过淋巴细胞,颗粒的分布取决于颗粒的大小和表面电荷(Hussain等,1997;Delie,1998)。
但是,只有小部分的纳米粒子由被动吸收(Lamprou等,2013)。
多年来,人们一直在探索使用功能化的纳米系统进行受体介导的药物递送,以提高药物的治疗指数(Gref等,1994;Peer等,2007;Zhu等,2012;Mura等,2013; Cheng 等2015a)。
环糊精已被广泛用于药物递送,尤其适用于小分子递送。对环糊精纳米粒子技术的进步和潜在的前景进行了评估(Adeoye和Cabral-Marques,2017年)。
最近用维生素B12(Petrus等,2009;Fowler等,2013)、叶酸受体(Anderson等,2001;Roger等,2012)、新生儿fc受体(Pridgen等,2013)和转铁蛋白受体(TfR;Amet等,2010;Shofner等,2010;Du等,2013)等受体介导增强纳米系统靶向递送的可能。
纳米技术应用于药物递送的近期发展概况见表4。
尽管前景可期,受体介导的药物递送方法目前使用的内源性配体去修饰颗粒,这种方式可能被高浓度的生理配体所竞争(Lundquist和Artursson,2016)。
为了解决这一局限性,我们的实验室最近报道了使用藤黄酸(GA),作为小肠中TfR的非竞争性配体(Saini等,2016; Ganugula等,2017a),它与转铁蛋白受体有很高的亲和力,不受是否与转铁蛋白结合影响(Kasibhatla等,2005)。
GA修饰的聚乳酸-羟基乙共聚物纳米粒子在细胞中表现出非竞争性转运,并改善了包封的药物或药物类似合物(例如环孢菌素、姜黄素和胰岛素)的在啮齿动物体内的口服生物利用度(Saini等,2016;Ganugula等,2017a;Kaur 等 2019)。
我们的实验室还观察到配体-受体化学计量学在受体介导的药物递送中起重要作用。
通过新形成的聚酯中多位点偶联,优化配体-受体计量,与基准对照相比,GA修饰的聚乳酸-羟基乙共聚物显示出吸收增强和有效的药物递送(Ganugula等,2017b)。
对于一些慢性病的口服给药治疗,该方法可能会提高生物利用度,从而有益于临床治疗。
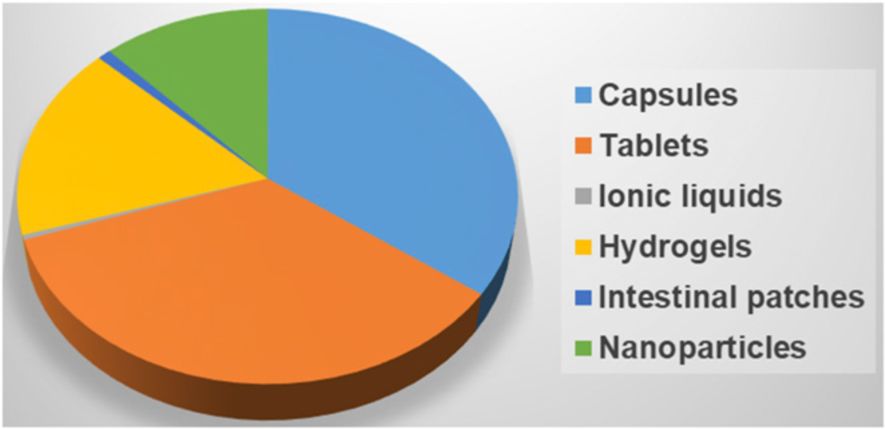
图12 不同口服药物递送技术的专利分布图
外泌体 外泌体是生物来源的碟形纳米囊泡(图11),其参与细胞通讯并充当细胞信使,以促进脂质、蛋白质和RNA从一个细胞转运到另一个细胞(Zomer等,2010)。
已研究了外泌体作为纳米载体,跨细胞屏障递送大分子(例如肽,蛋白质,RNA等)(Alvarez-Erviti等,2011; Kamerkar等,2017; Wang等,2018)。
通常,通过离心将外泌体与死细胞和其他碎片分离,然后通过蔗糖梯度法进行分离。
外泌体可以从牛奶中获得:用盐酸通过等电沉淀除去乳蛋白(酪蛋白),然后离心除去碎片(Yamauchi等,2019)。作为细胞信使,牛奶来源的外泌体已被用作各种大分子载体,如蛋白质,微小RNA,抗癌药物等(Munagala等,2016;Samuel等,2017;Manca等,2018)。
这些纳米装置具有较好的成本收益比、工艺可放大性和生物相容性,并且在没有引起免疫应答的情况下,增强药物生物利用度和跨物种耐受性。
此外,外泌体可以被功能化修饰,用于靶向递送药物。牛奶来源的外泌体已用于提供类黄酮,如作为多种癌症类型的抗癌分子的Anthos(Munagala等,2017)。
与此同时,牛奶来源的外泌体已用于紫杉醇的口服药物递送,以增强药效并减少与药物相关的副作用(Agrawal等,2017)。
未来前景
从简单的片剂到复杂的纳米粒子技术,口服给药技术已经走过了漫长的道路(图12)。
这得益于对肠道屏障和对门静脉和肠道淋巴管进入体循环的途径的了解。
大量关于小分子和大分子在肠道屏障传递的文献,给我们对非常规递送策略的信心。虽然递送技术与活性成分(药物)一样重要,但我们应该意识到一种技术并不适合所有药物。
在考虑传递技术时,需要了解可以改进的空间;在创新和风险间取得平衡对确保顺利转化同样重要。成功最终取决于简单性,而研究重点应放在借助递送技术来优化最低有效治疗浓度上。
因为我们已经了解了药理和安全性情况,可以极大降低药物临床阶段的风险,所以用非常规口服递送策略来重新调整现有药物是合理的。
口服给药不需要无菌,这也一个附加的0/I期临床的优点,只要建立了充足的安全措施,可以进行人体有效性研究。
参考文献(略)
本系列连载文章全文完。
▼同写意15周年大会日程正式发布!10月底,同写意将在苏州金鸡湖畔举办15周年全球生物技术前沿千人大会,汇聚近200位新药领军人物,点击查看详细日程。









